Untersuchung des Einflusses der Tiefenhirnstimulation auf neurorestaurative Effekte (synaptische Plastizität und Neurogenese ) im 6-Hydroxydopamin Hemiparkinsonmodell der Ratte
Tiefenhirnstimulation bei Parkinson-Patienten
Die Möglichkeit, elektromagnetische Felder zu nutzen, um die neuronale Aktivität zu modulieren und verlorene Funktionen wieder herzustellen, ist ein aufstrebendes Gebiet für die Behandlung einer wachsenden Anzahl neurologischer und psychiatrischer Erkrankungen. Die Tiefenhirnstimulation (THS) ist nur ein Beispiel für eine neue Generation von Medizinprodukten mit dem jüngst geprägten Begriff „Elektrozeutika“, die eine Synergie zwischen Elektronik und Biologie darstellen [Famm et al. 2013]. Die Parkinson-Krankheit ist durch einen fortschreitenden Verlust an dopaminergen Neuronen mit nachfolgendem Dopaminverlust und der damit zusammenhängenden Störung des neuronalen Netzwerkes der Basalganglien gekennzeichnet, der zu charakteristischen motorischen Symptomen einschließlich Bradykinesie, Tremor und Muskelsteifigkeit führt. Im fortgeschrittenen Stadium der Erkrankung kommen erschwerend motorische Schwankungen hinzu, die sich im Tagesverlauf als Wechsel akinetischer und hyperkinetischer motorischer Zustände darstellen [Weiner et al. 2016], sowie nicht-motorische Symptome, wie Riechstörung, Depression, Angst und kognitive Einschränkung [Dafsari et al. 2016, Cury et al. 2014]. Das aktuelle Standardbehandlungsverfahren ist eine Dopamin-Substitution durch verschiedene pharmakologische Strategien wie z.B.: der Levodopa-Therapie, die jedoch insbesondere im angesprochenen fortgeschrittenen Stadium unzureichend ist. THS ist ein inzwischen routinemäßiger alternativer therapeutischer Ansatz für Patienten, die nicht ausreichend durch pharmakologische Behandlung therapiert werden können. Historisch gesehen wurde THS als eine Modifikation der ablativen (abtragenden) Chirurgie entwickelt, in denen Teile der Basalganglien als letzte Behandlungsoption irreversibel zerstört wurden [Miocinovic et al. 2013]. Während der Operation wurde elektrische Stimulation dazu genutzt, um Neurochirurgen zur genauen Position der geplanten Läsion zu leiten. Die Hauptvorteile der THS gegenüber chirurgischen Läsionen sind deren Reversibilität und die Fähigkeit, die elektrischen Stimulationsparameter zu modulieren. Der subthalamische Nukleus (STN) und der Globus Pallidus internus (GPI) sind nach wie vor die wichtigsten Zielregionen für THS. Bei Patienten, die refraktär gegenüber medikamentöser Behandlung sind, können die motorischen Fluktuationen nachweislich minimiert werden [Weaver et al. 2009, Moro et al. 2010, Moustafa et al. 2016, Follet et al. 2012, Odekerken et al. 2013]. Eine randomisierte Studie mit 156 Parkinsonpatienten im fortgeschrittenen Stadium der Erkrankung zeigte, dass bilaterale STN-THS in der Lage ist motorische Funktionen zu verbessern, deren Fluktuationen zu minimieren und den Bedarf an Levodopa zu senken [Deuschl et al. 2006]. Frequenzen von 90 bis 130 Hz werden im Allgemeinen als optimal betrachtet, um die therapeutischen Wirkungen von THS hervorzurufen [Ryu et al. 2013]. In diesem Frequenzbereich sind die klinisch beobachteten Vorteile maximal und ein normalisiertes Aktivitätsmuster der involvierten Nuklei wird wiederhergestellt [Santaniello et al. 2015]. Laut einer jüngeren Studie zeigen Patienten im fortgeschritten Stadium der Erkrankung, die refraktär gegenüber einer Stimulation im oben genannten Frequenzbereich waren, eine Verbesserung der segmentalen und axialen Symptome, der Gangstörung und der Levodopa-induzierten Dyskinesie nach einer Reduktion der Stimulationsfrequenz auf 60 Hz [Ramdhani et al. 2015].
Dies zeigt beispielhaft, dass die genauen Wirkungsmechanismen der THS immer noch unklar sind und optimale Parameter nicht bekannt. Dennoch wurden mehrere Theorien auf den Weg gebracht: In Abhängigkeit der Latenzzeit mit denen sich klinische Effekte beobachten lassen erfolgt eine Einteilung in akute und chronische Wirkmechanismen. Akute Effekte treten innerhalb von Sekunden bis Stunden auf und werden wahrscheinlich durch mehrere, nicht exklusive Mechanismen einschließlich lokaler und netzwerkweiter elektrischer und neurochemischer Effekte der Stimulation, Modulation der Oszillationsaktivität und potentiell synaptischer Plastizität vermittelt [Herrington et al. 2016], wohingegen die chronischen Effekte erst nach Tagen oder gar Monaten auftreten und höchstwahrscheinlich auf Veränderungen der synaptischen und zellulären Plastizität (Neurogenese) zurückzuführen sind [Lozano et al. 2013, Udupa et al. 2015]. Studien zeigen, dass akute THS-Effekte insbesondere bei der Therapie von motorischen Symptomen eine Rolle spielen, wohingegen sich therapeutische Effekte bei nicht-motorischen Symptomen erst nach längeren Zeiträumen zeigen.
Eine erfolgreiche Linderung motorischer und nicht-motorischer Symptome ist entscheidend für die Lebensqualität von Patienten mit der Parkinson-Krankheit. Der symptomabhängige Zeitverlauf der THS-Effekte stützt stark die Hypothese, dass diese Effekte unterschiedlichen Wirkmechanismen unterliegen.
THS am Tiermodell der Parkinson-Krankheit
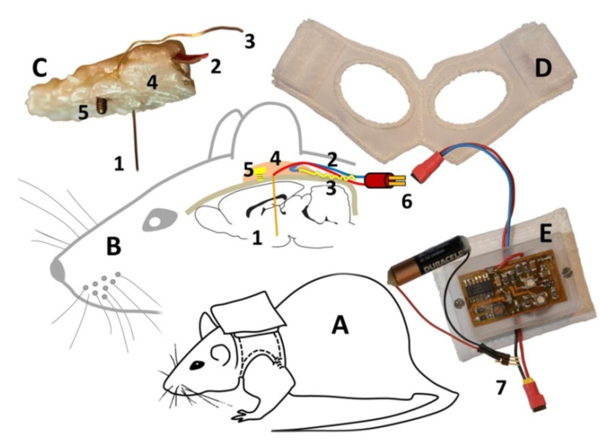
Wie oben beschrieben, wurde die THS-Technologie historisch bedingt in einer klinischen Umgebung entwickelt. Tiermodelle der Parkinson-Krankheit tragen massiv zum Verständnis, sowie zur Optimierung von Zielregionen und Stimulationsparametern beim Menschen bei [Benazzouz et al. 1993, Benabid et al. 1994, Tass et al. 2011]. Diese Studien führten insbesondere zu einem besseren Verständnis der akuten THS-Effekte auf die motorischen Symptome [Herrington et al. 2016]. Dennoch sind deutlich mehr Informationen erforderlich, um das volle therapeutische Potenzial von THS zu ergründen, denn die grundlegenden Wirkmechanismen sind immer noch unzureichend verstanden [Santaniello et al. 2015, Udupa et al. 2015, Collins et al. 2010, Wilson et al. 2011, Pizzolato et al. 2012]. Um jedoch einen Vergleich mit der klinischen Situation zuzulassen, ist die Verfügbarkeit von Tiermodellen für Langzeituntersuchungen und Verhaltenstests von größter Bedeutung. Solche Tiermodelle erlauben die Untersuchung von Arzneimittel-induziertem oder spontanem Verhalten, d.h. die Effekte von Läsions- bzw. THS-induzierten Veränderungen der motorischen Funktionalität und des Verhaltens können quantifiziert werden. Das in Abbildung 1 gezeigte System [Badstuebner 2017b] ermöglicht Verhaltensuntersuchungen von vollkommen frei beweglichen Ratten mit chronischer Instrumentierung von bis zu 6 Wochen. Begleitende Impedanzmessungen ermöglichen die Charakterisierung der Elektroden-Gewebe-Kontaktzone [Badstuebner 2017a].
Literatur
Badstuebner K, Stubbe M, Kroeger T, Mix E, Gimsa J. Impedance detection of the electrical resistivity of the wound tissue around deep brain stimulation electrodes permits registration of the encapsulation process in a rat model. Journal of Electrical Bioimpedance 2017; 8(1): 11-24.
Badstuebner K, Gimsa U, Weber I, Tuchscherer A, Gimsa J. Deep brain stimulation of hemiparkinsonian rats with unipolar and bipolar electrodes for up to 6 weeks – behavioral testing of freely moving animals. Parkinson’s Disease 2017. Article in press (5693589).
Benabid AL, Pollak P, Gross C, et al. Acute and long-term effects of subthalamic nucleus stimulation in Parkinson's disease. Stereotactic and functional neurosurgery 1994; 62(1-4): 76-84.
Benazzouz A, Gross C, Feger J, Boraud T, Bioulac B. Reversal of rigidity and improvement in motor performance by subthalamic high-frequency stimulation in MPTP-treated monkeys. The European journal of neuroscience 1993; 5(4): 382-9.
Collins KL, Lehmann EM, Patil PG. Deep brain stimulation for movement disorders. Neurobiology of disease 2010; 38(3): 338-45.
Cury RG, Galhardoni R, Fonoff ET, et al. Effects of deep brain stimulation on pain and other nonmotor symptoms in Parkinson disease. Neurology 2014; 83(16): 1403-9.
Dafsari HS, Reddy P, Herchenbach C, et al. Beneficial Effects of Bilateral Subthalamic Stimulation on Non-Motor Symptoms in Parkinson's Disease. Brain stimulation 2016; 9(1): 78-85.
Deuschl G, Schade-Brittinger C, Krack P, et al. A randomized trial of deep-brain stimulation for Parkinson's disease. The New England journal of medicine 2006; 355(9): 896-908.
Famm K, Litt B, Tracey KJ, Boyden ES, Slaoui M. Drug discovery: a jump-start for electroceuticals. Nature 2013; 496(7444): 159-61.
Follett KA, Torres-Russotto D. Deep brain stimulation of globus pallidus interna, subthalamic nucleus, and pedunculopontine nucleus for Parkinson's disease: which target? Parkinsonism Relat Disord 2012; 18 Suppl 1: S165-7.
Herrington TM, Cheng JJ, Eskandar EN. Mechanisms of deep brain stimulation. Journal of neurophysiology 2016; 115(1): 19-38.
Lozano AM, Lipsman N. Probing and regulating dysfunctional circuits using deep brain stimulation. Neuron 2013; 77(3): 406-24.
Miocinovic S, Somayajula S, Chitnis S, Vitek JL. History, applications, and mechanisms of deep brain stimulation. JAMA neurology 2013; 70(2): 163-71.
Moro E, Lozano AM, Pollak P, et al. Long-term results of a multicenter study on subthalamic and pallidal stimulation in Parkinson's disease. Movement disorders : official journal of the Movement Disorder Society 2010; 25(5): 578-86.
Moustafa AA, Chakravarthy S, Phillips JR, et al. Motor symptoms in Parkinson's disease: A unified framework. Neurosci Biobehav Rev 2016; 68: 727-40.
Odekerken VJ, van Laar T, Staal MJ, et al. Subthalamic nucleus versus globus pallidus bilateral deep brain stimulation for advanced Parkinson's disease (NSTAPS study): a randomised controlled trial. Lancet Neurol 2013; 12(1): 37-44.
Pizzolato G, Mandat T. Deep brain stimulation for movement disorders. Frontiers in integrative neuroscience 2012; 6: 2.
Ramdhani RA, Patel A, Swope D, Kopell BH. Early Use of 60 Hz Frequency Subthalamic Stimulation in Parkinson's Disease: A Case Series and Review. Neuromodulation 2015; 18(8): 664-9.
Ryu SB, Bae EK, Kim J, et al. Neuronal Responses in the Globus Pallidus during Subthalamic Nucleus Electrical Stimulation in Normal and Parkinson's Disease Model Rats. The Korean journal of physiology & pharmacology : official journal of the Korean Physiological Society and the Korean Society of Pharmacology 2013; 17(4): 299-306.
Santaniello S, McCarthy MM, Montgomery EB, Jr., Gale JT, Kopell N, Sarma SV. Therapeutic mechanisms of high-frequency stimulation in Parkinson's disease and neural restoration via loop-based reinforcement. Proceedings of the National Academy of Sciences of the United States of America 2015; 112(6): E586-95.
Tass PA, Qin L, Hauptmann C, et al. The translational value of the MPTP non-human primate model of Parkinsonism for deep brain stimulation research. Conference proceedings : Annual International Conference of the IEEE Engineering in Medicine and Biology Society IEEE Engineering in Medicine and Biology Society Annual Conference 2011; 2011: 663-6.
Udupa K, Chen R. The mechanisms of action of deep brain stimulation and ideas for the future development. Progress in neurobiology 2015; 133: 27-49.
Wilson CJ, Beverlin B, 2nd, Netoff T. Chaotic desynchronization as the therapeutic mechanism of deep brain stimulation. Frontiers in systems neuroscience 2011; 5: 50.
Weaver FM, Follett K, Stern M, et al. Bilateral deep brain stimulation vs best medical therapy for patients with advanced Parkinson disease: a randomized controlled trial. Jama 2009; 301(1): 63-73.
Weiner WJ. Motor fluctuations in Parkinson's disease. Reviews in neurological diseases 2006; 3(3): 101-8.
Aktuelle Projekte
Sonderforschungsbereich SFB 1270 ELektrisch Aktive ImplaNtatE – ELAINE
Teilprojekt C04 „Effects of deep brain stimulation on adult neurogenesis in a rat model of Parkinson’s disease: Mechanisms of action, stimulation parameters and correlation with behaviour” (https://www.elaine.uni-rostock.de/)
FORUN 2017
