AG Experimentelle Tiefenhirnstimulation
Die AG Experimentelle Tiefenhirnstimulation (Leiterin: Dr. med. Mareike Fauser) befasst sich vorrangig mit den Wirkungen und der Wirkweise einer Tiefenhirnstimulation im Parkinsonmodell. Unser Ziel ist es, dieses in der klinischen Anwendung seit Jahrzehnten verfügbare Verfahren besser zu charakterisieren und dadurch zukünftig zu einer Optimierung der Tiefenhirnstimulation bei Parkinsonpatienten beizutragen.
Die Parkinson-Krankheit ist eine der häufigsten neurodegenerativen Erkrankungen mit einer Prävalenz von ca. 100 pro 100.000 in der Altersgruppe bis 60 Jahre, welche jedoch bei den über 80jährigen bereits auf ca. 3.000 pro 100.000 ansteigt. Es präsentiert sich klinisch klassischerweise mit der Trias aus (Ruhe-)Tremor (=Zittern), Rigor (= Muskelsteifigkeit) und Bradykinese (= allgemeiner Bewegungsverlangsamung). In den letzten Jahren und Jahrzehnten zeigte sich jedoch zunehmend, dass auch sogenannte nicht-motorische Symptome eine wesentliche Rolle insbesondere für die Lebensqualität der Patienten spielen. Bestimmte nicht-motorische Symptome (bspw. Riechstörungen und die REM-Schlaf-Verhaltensstörung) können sogar vor Beginn der motorischen Symptomatik auftreten. Bislang sind die verfügbaren Therapieverfahren ausschließlich symptomatischer Natur, eine Krankheitsmodifikation ist nicht möglich. Die Tiefenhirnstimulation (THS) bei Parkinsonpatienten kommt bislang vorrangig im mittleren bis späten Krankheitsstadium zum Einsatz, wenn medikamentöse Therapieansätze nicht mehr zu einer ausreichenden Symptomlinderung führen, könnte jedoch das Potential besitzen, auch frühzeitig auftretende nicht-motorische Symptome abzuschwächen.
In unserer Arbeitsgruppe beschäftigen wir uns aktuell mit der Wirkung der THS auf die zelluläre Plastizität, wobei wir sowohl den Einfluss auf verschiedene dopaminerge Systeme als auch auf die adulte Neurogenese in einem etablierten Hemiparkinsonmodell untersuchen. Hier konnten wir zeigen, dass eine Langzeit-Tiefenhirnstimulation sowohl zu einer Zunahme dopaminerger Zellen im Mittelhirn als auch zu einer Vermehrung neu entstandener dopaminerger Interneurone im Bulbus olfactorius führt. Diese Effekte scheinen vom Stimulationsort abhängig zu sein und ließen sich ausschließlich bei Stimulation im Nucleus subthalamicus und nicht bei einer Stimulation im Globus pallidus pars internus (in der Ratte: Nucleus entopeduncularis) nachweisen. Aktuell interessiert uns besonders der potentielle Zusammenhang zwischen zellulärer Plastizität und nicht-motorischen Symptomen der Parkinsonerkrankung, wobei für diese Fragestellung ein alternatives, alpha-Synuclein exprimierendes Tiermodell zur Anwendung kommt. Zudem interessieren wir uns für den Einfluss einer THS auf die Expression trophischer Faktoren in bestimmten Gehirnarealen. Verifiziert werden diese Daten zusätzlich mittels in vitro Untersuchungen an neuronalen Stammzellen.
Im Rahmen des Sonderforschungsbereichs „ELAINE – ELektrisch Aktive ImplaNtatE“ arbeiten wir an der technischen Optimierung präklinischer Stimulationssysteme (Teilprojekt C04; Förderung durch die Deutsche Forschungsgesellschaft III/2021-IV/2025), um nun auch in experimentellen Modellen mit vollimplantierbaren Stimulationssystemen zu arbeiten (in Zusammenarbeit mit dem Institut für Angewandte Mikroelektronik und Datentechnik, Prof. Dirk Timmermann, Prof. Christian Haubelt). Mit diesen lassen sich funktionelle Einflüsse deutlich besser untersuchen als mit bislang verfügbaren externen Stimulatoren. Zusätzlich untersuchen wir im Rahmen des Konsortiums mit Kollegen der Elektrotechnik (Institut für Allgemeine Elektrotechnik, Lehrstuhl für Theoretische Elektrotechnik, Prof. Ursula van Rienen) die Feldverteilung sowie potentielle Einflüsse des Elektrodenmaterials und des Stimulationsmodus auf die Effekte der THS.
Leitung der Arbeitsgruppe

Frau Dr. med. Mareike Fauser

Apparative Ausstattung (Auswahl):
- Digitaler zweiarmiger Stereotaxie-Rahmen von Stoelting Neuroscience
- Forschungskryostat /Kryomikrotome CM3050S von Leica *
- Hochauflösendes Fluoreszenzmikroskop AxioObserver.Z1 mit Apotome von Zeiss
* kofinanziert von der Europäischen Union aus dem Europäischen Fonds für regionale Entwicklung
Literatur
- Fauser M, Payonk JP, Weber H, Statz M, Winter C, Hadar R, Appali R, van Rienen U, Brandt MD, Storch A. Subthalamic nucleus but not entopeduncular nucleus deep brain stimulation enhances neurogenesis in the SVZ-olfactory bulb system of Parkinsonian rats. Front Cell Neurosci. 2024 Apr 30;18:1396780. doi: 10.3389/fncel.2024.1396780.
- Statz M, Schleuter F, Weber H, Kober M, Plocksties F, Timmermann D, Storch A, Fauser M. Subthalamic nucleus deep brain stimulation does not alter growth factor expression in a rat model of stable dopaminergic deficiency. Neurosci Lett. 2023 Sep 25;814:137459. doi: 10.1016/j.neulet.2023.137459.
- Helf C, Kober M, Markert F, Lanto J, Overhoff L, Badstübner-Meeske K, Storch A, Fauser M. Subthalamic nucleus deep brain stimulation induces nigrostriatal dopaminergic plasticity in a stable rat model of Parkinson's disease. Neuroreport. 2023 Jun 7;34(10):506-511. doi: 10.1097/WNR.0000000000001917.
- Fauser M*, Loewenbrück KF*, Rangnick J, Brandt MD, Hermann A, Storch A. Adult Neural Stem Cells from Midbrain Periventricular Regions Show Limited Neurogenic Potential after Transplantation into the Hippocampal Neurogenic Niche. Cells. 2021 Nov 4;10(11):3021. doi: 10.3390/cells10113021.
- Fauser M, Ricken M, Markert F, Weis N, Schmitt O, Gimsa J, Winter C, Badstübner-Meeske K, Storch A. Subthalamic nucleus deep brain stimulation induces sustained neurorestoration in the mesolimbic dopaminergic system in a Parkinson's disease model. Neurobiol Dis. 2021 Aug;156:105404. doi: 10.1016/j.nbd.2021.105404.
- Fauser M, Pan-Montojo F, Richter C, Kahle PJ, Schwarz SC, Schwarz J, Storch A, Hermann A. Chronic-Progressive Dopaminergic Deficiency Does Not Induce Midbrain Neurogenesis. Cells. 2021 Mar 31;10(4):775. doi: 10.3390/cells10040775.
- Fauser M, Weselek G, Hauptmann C, Markert F, Gerlach M, Hermann A, Storch A. „Catecholaminergic innervation of periventricular neurogenic regions of the developing mouse brain”. In: Front Neuroanat 14 (2020).
- Weselek G, Keiner S, Fauser M, Wagenführ L, Müller J, Kaltschmidt B, Brandt MD, Gerlach M, Redecker C, Hermann A, and Storch A. “Norepinephrine is a negative regulator of the adult periventricular neural stem cell niche”. In: Stem Cells 38.9 (2020), pp. 1188–201.
Einfluss einer chronischen Tiefen Hirnstimulation auf die adulte Neurogenese
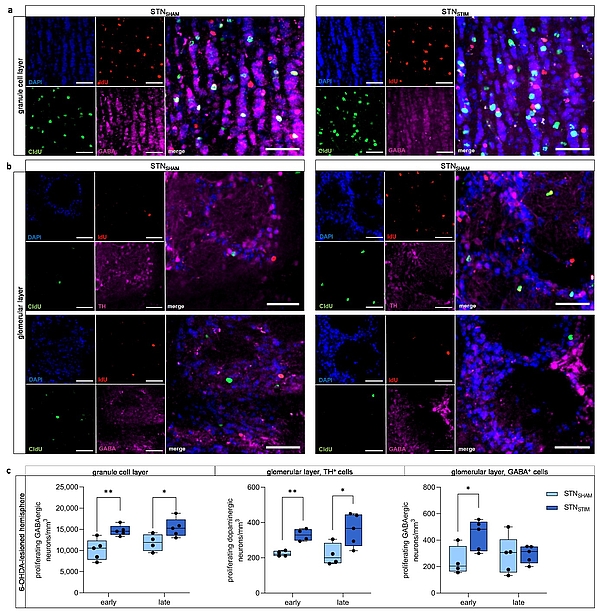
Abbildung 1: Einfluss einer Tiefenhirnstimulation im Nucleus subthalamicus (STN) bzw. einer SHAM-(Schein-)Stimulation auf die Anzahl dopaminerger (Dopamin produzierender) Neurone im Mittelhirn in einem Hemiparkinsonmodell (immunhistochemische Färbung der Tyrosinhydroxylase mittels DAB) auf der läsionierten und nicht-läsionierten Hemisphäre (a,b) in der Substantia nigra pars compacta (SNpc; c, d) und dem ventralen tegmentalen Areal (VTA; e, f).
(a, b) Repräsentative immunhistologische Bilder von neu entstandenen Neuronen im BO unter STNSHAM- und STNSTIM-Bedingungen. IdU (rot) markiert neu entstandene Neurone, die früh (zwei Tage) nach Beginn der THS erzeugt wurden, während CldU (grün) neu entstandene Neurone nach drei Wochen kontinuierlicher THS markiert. GABAerge Neuronen (pink) finden sich sowohl in der granulären Schicht (a) als auch in der glomerulären Schicht (b, untere Zeile), während TH+ dopaminerge Neurone (pink) auf letztere beschränkt sind (b, obere Zeile). Zellkerne wurden mit DAPI gegengefärbt. Maßstabsbalken, 50 µm. (c) Ein signifikanter Anstieg der Anzahl neu entstandener GABAerger Neurone in der granulären Schicht und TH+ dopaminerger Neurone in der glomerulären Schicht wurde sowohl früh nach Beginn der STN-THS als auch drei Wochen später festgestellt, während GABAerge Neurone in der glomerulären Schicht nur unmittelbar nach Beginn der der STN-THS im Vergleich zur SHAM-Stimulation signifikant erhöht waren. Alle Ergebnisse wurden an 6-OHDA-läsionierten Hemisphären gewonnen (erschienen in Fauser et al., Front Cell Neurosci, 2024).



Mitglieder:
Dr. med. Mareike Fauser (Junior-Gruppenleiterin)
M.Sc. Meike Statz (PhD-Studentin)
M.Sc. Hanna Weber (PhD-Studentin)
Uta Naumann (Veterinäringenieurin)
Sarah Pfeisinger (Masterstudentin)
Valeriia Abramenko (IRTG-Stipendiatin, med. Doktorandin)
Maximilian Steinigk (Arzt, med. Doktorand)
Caroline Ocker (med. Doktorandin)
Raja Barthel (med. Doktorandin)
Ehemalige Mitglieder:
Dr. rer. nat. Kathrin Badstübner-Meeske
Dr. rer. nat. Francia Molina (Postdoc)
M.Sc. Maria Kober (PhD Studentin)
M.Sc. Frederike Schleuter (Masterstudentin)
Franziska Backhaus (med. Doktorandin)
Felix Bernsdorff (med. Doktorand)
Charlotte Helf (med. Doktorandin)
Martin Nüssel (med. Doktorand)
Leonie Overhoff (med. Doktorandin)
Dr. med. Manuel Ricken
